Thèse de physique
présentée à Faculté des Sciences
de l'Université de
Poitiers
pour obtenir le grade de Docteur es Sciences
Physiques
par ¶
Georges Charles
L'alcoylidénation
par les imines des groupes méthylènes activés
soutenue le 2 mars 1963
devant la commission
d'examen :
Valensi, G., président
Casadevall, A., Dubois, J. E., examinateurs
INTRODUCTION
Les composés
carbonylés se condensent avec les groupes méthylènes activés suivant le schéma :

Cette réaction, connue
généralement sous le nom de réaction de KNOEVENAGEL
(1898), aboutit à la création d'une
liaison éthylénique (alcoylidénation). La présente étude est relative aux
condensations parallèles des composés imines :
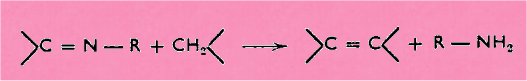
et constitue
donc le pendant de l'étude de KNOEVENAGEL.
Elle contient essentiellement
une nouvelle méthode d'alcoylidénation, par les
cétimines, des groupes méthylènes activés. Son intérêt, pour la synthèse, réside dans le fait qu'elle complète
notablement la méthode de KNOEVENAGEL. En effet, la réactivité des groupes carbonylés et méthylènes actifs
décroît respectivement dans l'ordre suivant :
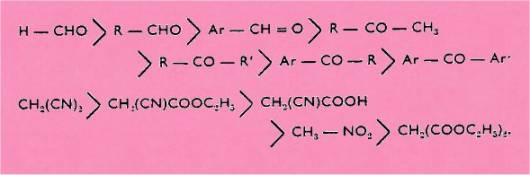
En
conséquence, la réaction de KNOEVENAGEL est freinée par la moins grande
réactivité du carbonyle et du groupe méthylène. Ainsi, l'alcoylidénation des composés méthyléniques
moyennement ou peu réactifs (comme l'acide cyanacétique, le nitrométhane et le malonate
diéthylique) paraît limitée aux
dialcoylcétones, voire aux aldéhydes. A notre connaissance, parmi ces composés méthyléniques, aucun ne semble avoir été
condensé avec les a-arylcétones. L'utilisation des imines et, plus particulièrement, des a-arylcétimines était
susceptible de réaliser l'alcoylidénation de ces composés.
Cette étude
nous a paru présenter un intérêt théorique et pratique; nous avons donc entrepris de la
conduire systématiquement dans ces
directions. Un grand nombre< de
composés méthyléniques, des plus réactifs aux moins réactifs, ont été opposés à
différents groupes d'imines (aldimines
N-substituées, hydramides, cétimines libres et N-substituées), afin d'examiner les limites du
domaine d'application, dans le
cadre de la synthèse organique, de cette méthode d'alcoylidénation.
Le tableau I, dans lequel les composés carbonylés
et méthyléniques ont été
classés (approximativement pour ces derniers) par ordre de réactivité décroissante, résume l'étendue de notre analyse
relative aux condensations des
imines avec les groupes méthylènes activés, par rapport aux résultats connus concernant les
aldéhydes et les cétones.
Par ailleurs,
nous en avons étudié les différents aspects en vue d'en discuter le mécanisme de réaction. Ceci
nous a amené, en outre, à revoir
le mécanisme proposé par COPE
pour la réaction de KNOEVENAGEL.
Les principales conclusions de ce travail sont les
suivantes :
A. Conclusions expérimentales
Le résultat
essentiel de la présente étude réside dans l'élaboration d'une nouvelle méthode d'
alcoylidénation, utilisant la condensation
cétimine-composé méthylénique, méthode qui complète notablement la réaction
de KNVENAGEL-DBNER-COPE :
1) L'alcoylidénation, par les cétones peu réactives
(les diarylcétones
particulièrement), des composés méthyléniques suivants, n'a jamais été
réalisée, à notre connaissance : cyanacétamide, aroylacétonitriles, acide cyanacétique, nitroalcanes;
elle s'effectue par contre facilement
en partant des cétimines correspondantes (des diarylcétimines particulièrement).
2) Dans le cas du malonitrile et du cyanacétate
d'éthyle, dont l'alcoylidénation peut
être réalisée soit à partir des cétones, soit à partir des cétimines, l'utilisation de ces dernières présente des
avantages très nets : rapidité de la réaction, rendements plus élevés en général, produits de condensation faciles à
isoler et à purifier.
B. Conclusions théoriques :
1) Les
données expérimentales relatives à la réaction de KNVENAGEL-COPE nous paraissent incompatibles avec un mécanisme unique.
En particulier, le mécanisme classique
qui suppose une dissociation du pseudo acide, est en contradiction avec certains faits
d'expérience et ne semble pas
devoir s'appliquer à tous les cas. Il nous paraît nécessaire d'envisager plusieurs mécanismes réactionnels tenant
compte, dans les conditions utilisées, de la réactivité du carbonyle et du composé méthylénique,
ainsi que de la nature du
catalyseur.
2) Pour
l'alcoylidénation du cyanacétate d'éthyle par les diarylcétones, nous proposons un mécanisme
faisant intervenir une imine comme
entité réagissante, en accord avec
le fait que seules les bases pouvant donner une imine avec la cétone, catalysent cette réaction.
3) Ce mécanisme implique une réactivité plus
grande des imines par rapport aux
cétones, ce qui a été vérifié dans
la plupart des cas.
Cette réactivité supérieure des imines,
particulièrement nette dans le
cas des diarylcétimines trouve, semble-t-il, une explication simple dans le fait que l'azote
iminique est beaucoup plus basique
que l'oxygène carbonylique. Les
échanges de protons entre le pseudo acide méthylénique et l'imine se trouvent
ainsi facilités.
4) Tenant compte du fait que l'alcoylidénation par
les imines des groupes méthylènes
activés s'effectue en milieu peu
ionisant, nous proposons un processus réactionnel pour lequel nous avons
retenu le modèle de complexes de
transition à quatre atomes. Ces états de transition permettent de rendre compte
des deux transferts de protons et des deux transferts circulaires d'électrons qui accompagnent
l'aminoalcoylation et la désamination.
Mots clefs : acide / alcoylidénation / aldéhyde / aldimine / aminoalcoylation /
aroylacétonitrile / arylcétimine / arylcétone / azote / carbonyle / carbonylique / catalyseur /
cétimine / cétone / composé / condensation / cope / cyanacétamide / cyanacétate / cyanacétique /
dialcoylcétone / diarylcétimine / diarylcétone / diéthylique / DBNER / éthyle / éthylénique /
hydramide / imine / iminique / knoevenagel / malonate / malonitrile / mécanisme / méthylène /
méthylénique / nitroalcane / nitrométhane / oxygène / proton / réactif / réactivité / charles /
valensi